
李长青博士 埃格林医药CMO
“仅仅是比较肿瘤切块,同一个动物模型里,双药治疗后的平均肿瘤重量约为730毫克,而我们的三药治疗方案只剩下300多毫克。”对话中,李长青有些兴奋地向写意君分享,“这非常直观展示了EG-007组合的效果。”
EG-007是李长青加入埃格林医药后领导的首个候选药物。7月中旬,李长青出任埃格林医药CMO一职。随后的8月,经过两次pre-IND meeting,EG-007与靶向药物、抗PD-1抗体类药物联用治疗晚期子宫内膜癌的III期关键性临床试验方案,得到FDA的同意。
值得注意是,被视为肿瘤治疗中的“黑马”——帕博利珠单抗(K药)与仑伐替尼(Lenvatinib)这一“可乐组合”,不久前刚拿到了FDA的完全批准,用于治疗晚期非微卫星高度不稳定(MSI-H)或错配修复缺陷(dMMR)子宫内膜癌患者。
“可乐组合”虽然尚未在国内获批,中国临床肿瘤协会,尤其是子宫内膜癌治疗准则已有所关注。李长青称,III期关键试验正在进行中,组合中的单药却分别在中国上市,实践中不存在联合使用的门槛。这也意味着,“可乐组合”把子宫内膜癌的治疗推向新高,成为全球该领域的“standard of care”。
因此,EG-007要做的事情,属于直接挑战新标准治疗的III期“头对头”。埃格林医药为EG-007设计的是优效试验,不但统计学上有意义,在临床上也要有意义。
“大家可能有个误区,最先听到一个候选药物直接进入III期临床,觉得很厉害;再看这个产品原来是‘老药’,就觉得没什么亮点。”李长青解释道,“实际上,‘老药’也不是全都能直接进III期。FDA更看重一个项目背后的临床价值。”
进入工业界前,李长青曾在FDA担任高级医学审评官,也是中国大陆留学人员以医生身份进入FDA临床审评的第一人。对FDA法规的熟稔,加之多年的评审经验,使李长青在主导推进EG-007项目时更加得心应手。
除了李长青之外,埃格林医药高管中,董事长杜涛、CEO杜新,以及具体参与到EG-007项目的药理学总监胡涛,都曾在FDA有过从业经历。正是这些标签,让埃格林医药区别于大部分biotech公司。
“我们正在探索一个新的方法论,一条能提高临床价值的道路。”这是李长青对EG-007项目的期望。换言之,EG-007在子宫内膜癌的初步成功,只是埃格林医药的一小步。一旦“老药新用”(drug repurpose)模式走通,埃格林医药有望迅速在其他适应症和管线上实现复刻,推动成果落地与上市。
“老”“新”之辩:提高临床价值方为王道
2018年,港股“18A”新政落地,国内迎来一波未获盈利的biotech公司IPO热潮。随后科创板开闸,进一步促成生物医药本土创新的风尚,first in class、best in class等话题,亦频频占据行业讨论焦点。
可问题在于,first in class似乎仍是个未能完全达成行业共识的概念。大量标榜first in class的项目在为数不多的细分赛道扎堆,将国内的创新环境带向泡沫横飞的境况。
7月,CDE发布《以临床价值为导向的抗肿瘤药物临床研发指导原则》征求意见稿,便是对创新乱象的一次矫正。“从我们角度来讲,first in class、best in class如果能够做成,当然也是很好的。”李长青回应说,“不过,这(些概念)只是表层。一个药物能否获批,或则应不应该给予相应的政策支持,本质上要看它是不是带来新的临床价值,即解决“未满足的临床需求。”
以FDA为例,目前已开通的优先审评、快速通道、突破性疗法以及加速审批等特别通道,核心目的是对潜在提高患者获益的药物,从开发到上市的不同阶段提供支持。“可乐组合”就曾因Study 111/KEYNOTE-146研究中子宫内膜癌队列的良好的中期结果,在2018年被FDA授予突破性疗法认定。
细看“可乐组合”的作用机制,K药主要阻断PD-1免疫逃逸通路,而仑伐替尼则通过竞争性抑制VEGF和相应受体结合,抑制肿瘤细胞和TAM的生长分化——无论是其中哪一个,此前已都有不少成熟的研究。
“如果用严格的标准,已经上市批准的药都可以算作‘老药’,那么即使被誉为‘抗癌神药’的PD-1单抗,也属于‘老药’。然而,这并不是影响它的后续开发,只要能够获益的适应症、组合,都是药监部门所欢迎的。”李长青举例说。
不仅国际药企日渐重视“老药新用”的创新策略,NIH等研究机构也将之视为战略布局领域。在过去的十余年中,NIH以不同方式多次指出,希望通过测试治疗不同疾病的已获批准的药物,来帮助加快药物的开发和削减成本。

老药新用开发时间,费用和专利保护
比较研发成本数据,一款新药上市大概耗费10年时间,投入约10亿美元,但成功率只有10%。甚至在抗肿瘤领域,成功率不到4%。“老药新用”则更加诱人,不但省时(6年)省钱(3亿美元),成功率还高(25%)。
提高临床价值并不局限于疗效的改善,很大程度上,也要看患者的负担情况。形象地理解,“老药新用”一端抬升了成功率,另一端拉低了研发成本,最终有助于“药好价廉”的多赢局面。
同时,“老药新用”也受到很严密的专利保护。无论是在中国还是在欧美国家,如果一个老药经过研究,发现了新的用途,可以申请获得“新用途专利”。而“新用途专利”属于是保护力度很强和保护范围很广的发明专利。因此,“老药新用”是国际上医药工业的一种新趋势。
“把‘老药新用’这个看起来普通的事情做到极致,这是我们的信念。”李长青将“极致”形容为“在巨人头上给皇冠做珠子”,EG-007项目便是上述信念的实践。由于只需要开展一项III期临床,并且组合里都是获批的“老药”,省去了额外证明单药有效性的环节,李长青称,这为埃格林医药节省了六成的费用和时间。
埃格林医药的三药组合,核心仍旧围绕着改善肿瘤内部微环境(TME),借助不同的机制协同,把“冷肿瘤”变为“热肿瘤”,增加组织里的T细胞侵润,以强化杀伤肿瘤的效果。这是我们的药物对联合使用和作用机制的关键贡献. 援引李长青给到的另一组数据,埃格林医药的三药组合对动物模型肿瘤的抑制达到86%,而“可乐组合”是75%,单药治疗(Anti-PD1 antibody)的数据为69%。
02
对标“可乐组合”,EG-007翻越“三座大山”
直接快速进入III期临床,选择当前最佳组合切入,“头对头”的用药价值定位——套用李长青的说法,EG-007项目从一开始就按照“硬核”模式来推进。
以成立时间起算,当前埃格林医药刚刚过完了成立两周年的生日。但必须指出,上述理念并非国内生物医药创新窗口与资本市场风口迅速变小下的孤注一掷。相反,EG-007已经是埃格林医药第四个进入临床开发阶段的候选药物。
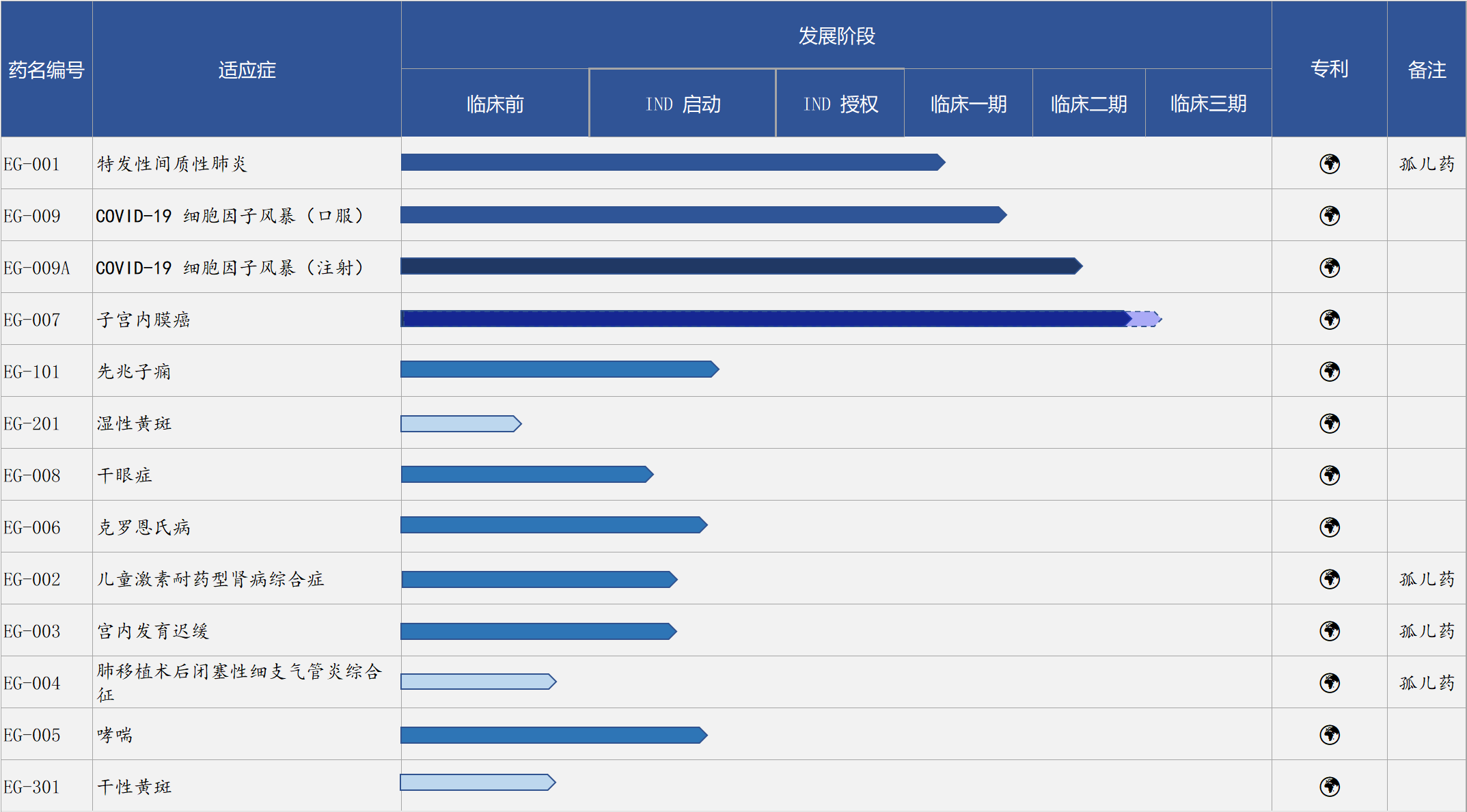
埃格林医药研发管线
不过,EG-007最初申请的是小规模的II期临床,达到一定的临床终点后,将其作为III期临床的部分资料,继续开发研究。
“我们制定了一个‘灯芯战略’,就像点燃蜡烛需要一根引线,我们在临床方案上,设计了一个类似‘灯芯’的小部分,小到只需要二三十个病人的II期临床。把这个‘灯芯’点燃后,我们就一鼓作气进入五六百人规模的III期临床。”李长青解释说。
考虑到子宫内膜癌的治疗需求与现有药物的应答率水平,在正式沟通时,FDA提出另一个方案,让EG-007跳过II期直接进入III期,所以才有了少见的第二次pre-IND meeting。“最终能够完成与FDA的顺利沟通,还得靠团队的法规背景积累。”李长青进一步补充,“FDA的政策在哪个地方弹性大,哪地方弹性小,这个判断力是非常重要。”
子宫内膜癌属于子宫内最常见的癌症类型,也是全球女性第六大癌症。数据显示,2020年全球有超41.7万新确诊病例和9.7万死亡病例。“可乐组合”的出现,给子宫内膜癌患者提供更多的希望,也让埃格林医药看到对标的方向。
“EG-007项目基于肿瘤微环境去开发,选组合的时候,我们对相关疗法进行全面分析,最终把视线落在‘可乐组合’上。对于肿瘤免疫联合治疗,它应该算是数一数二,目前已布局14个适应症,包括EG-007就有过探索的子宫内膜癌。”李长青对写意君讲述项目思路,“这个领域获批的新药还很少,疗效也有很大提升空间。所以,我们希望站在巨人肩上做得更好”
对比化疗组,“可乐组合”治疗子宫内膜癌患者的客观缓解率(ORR)增长了一倍,但也只是30%。随之而来的问题是,埃格林医药的三药组合,应该从“可乐组合”无法覆盖的70%患者入手,还是直接与它“头对头”?
“这实际上涉及到药物的临床定位,到底是做一线、二线还是三线治疗。”李长青认为,结合既往研究,EG-007项目可以直接在首选治疗方案上与“可乐组合”展开较量。
众所周知,针对所谓的“treatment failure”进行治疗,是不少临床试验的常规方式。毕竟机理没有很大改变,增加新的药物改善肿瘤微环境,或许能提升组合疗效。然而,倘若组合并不成功,情况就更为复杂:可能是源自微环境的改善不够,也可能是患者出现阻抗问题,甚至还包括其他未知影响因素。
另一厢,李长青也表示,从动物模型角度看,如何找到经治疗失败的动物,增加新的候选药物以进行MOA验证,同样存在一定难度。“所以我们觉得,‘头对头’一线治疗确实有风险,但综合起来,这反而是更合理的选择。”李长青总结道。
埃格林医药计划,EG-007项目会在100个以上临床试验点开展III期临床,覆盖10个以上国家和地区。在美国拿到IND后,针对欧洲、日本、中国等主要药物市场的临床申报也逐步提上日程。
“我们正在和多家CRO沟通,针对此次临床的推进展开合作。乐观估计,力争在3年内完成关键性III期试验,并在全球范围内提交新药申请。”李长青最后提及。
届时,埃格林医药从“first in disease”(新的适应症),到“first in treatment choice”(新的一线治疗),再到“first in patient choice”(满足患者的选择需求)的方法论,将获得坚实的案例背书。
文章转自同写意,如有侵权,请联系深圳埃格林医药有限公司删除。