转载 | 限制药物研发中的动物试验?虚惊一场过后的思考
来源:同写意
时间:Oct,2022
浏览次数:2869次
医药研发中的动物使用将会受到严格限制。近期,美国参议院通过了一项与医药工业相关的重要法案,《FDA现代化法案2.0》。该法案意在取消对新药研发中进行动物试验和取消生物仿制药的动物试验的强制性要求。
需要注意,美国FDA每年的财务预算是由美国国会批准,而不是由总统批准。既然上述法案已经获得了美国参议院一致通过,预计美国众议院也会顺利过关。所以,限制美国医药研发中的动物使用估计已成为定局。
长期以来,动物试验一直作为临床前药理研究和安全性评价的重要手段,是什么原因推动了此次法案的顺利通过?此次动物试验的取消意味着什么?我们通过研究动物试验替代技术发展历史,政治经济因素,及替代技术的最新进展或许不难找到答案。
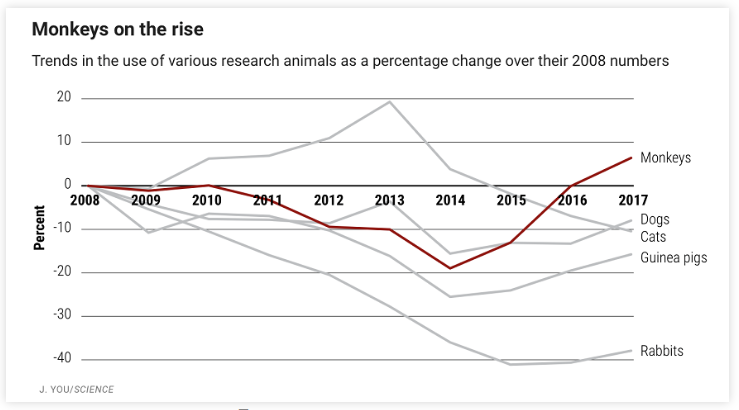
药物安全性评价是药物开发的重要环节,涉及识别化学品和生物制品对人类、植物、动物和环境的不良事件(AE)。而临床前安全性评估,是防止有毒药物进入临床试验的必要条件。尽管如此,安全性问题仍然是导致药物开发失败的主要原因,占上市后药物退出的三分之二和临床试验期间失败的五分之一。因此,对毒性的准确估计是确保药物安全的必要前提,也有助于降低将新药推向市场的开发时间和成本。不可否认,实验动物为医学的发展和药物的成功开发做出了重要贡献,同时也造成了动物遭受了痛苦的肉体折磨和不必要的死亡。其实,早在1959年英国动物学家William Russell和微生物学家Rex Burch就提出了3R理论,通过用减少(Reduce),优化(Refine),替代(Replace)三种方式来提高动物福利和优化实验设计来达到高效实验的目的。他们还提出了相对代替和绝对代替的概念,指出可利用低等动物、高等植物、微生物方法和生化检测的方法代替动物测试,并富有远见性地提出充分开发组织培养的观念。1978年英国生理学家David Symth主张将3R统称为替代方法(Alternatives)。3R理论提出以来,开拓了人们如何开展生命科学研究的思路,使得仁慈科学成为良好科学的前提,并激励科学家开始研究各种替代技术开发。3R原则一直影响着世界各国有关实验动物法规。目前,西方大多数国家的《实验动物福利法》均引入了3R原则。中国科技部2006年发布了《关于善待实验动物的指导性意见》。2019 年,美国环保署承诺将在2025年将动物试验数量减少 30%,并在2035年前结束所有用于评估化学品对人类健康和环境风险的哺乳动物试验。然而值得注意的是2035年的具体截止日期已从美国环保署(EPA)的2021年新技术方法(NAMs)工作计划中删除。药物安全是新药上市的主要挑战。意外的毒性和副作用是候选药物临床试验失败的主要原因之一,而上市后的药物安全问题会导致患者不必要提高的发病率和死亡率。2008年至2017年间,美国FDA批准了 321 种新药。同期,FDA不良事件报告系统(FAERS)记录了超过 1000 万份AE报告,其中580万份为严重报告,19%为与死亡相关的不良事件。仅以美国为例,不良事件给卫生系统带来负担,会导致每年200万次住院,并将就诊时间延长1.7至4.6 天。在现有的标准中,新药在进行临床试验前必须在两种动物里检验安全性,包括观察潜在毒副作用以及不同剂量下的表现。对于一个全新的候选药物,毒副作用存在不确定性,而在动物中提前进行体内测试可帮助降低临床试验药品安全的不确定性,目前这仍然是进入人体前的最后一道主要关卡。根据美国农业部的新数据,科学家去年使用了75825只非人类灵长类动物(NHP)进行研究,自2015年以来增长了22%,自2008年以来增长了6%。相比之下,美国农业部记录的猫,狗,兔子和其他动物的数量都比十年前使用得更少。美国是全球实验猴使用数量最多的国家,2008年起每年的使用量稳定在7万只左右。据美国农业部的实验猴使用数量报告显示:2018-2019年,美国实验猴使用数量分别是70797只和68257只。在美国所消耗的实验猴中,有约一半是通过进口获得的,其中60%的进口量来自于中国。2008-2017年美国各类实验动物的使用数量的变化百分比(来源:Science)
近几年中国加大了对创新药物研发的支持力度,中国的生物医药工业也开始了高速发展。这也造成了中国市场对实验动物的大量需求。然而,由于动物试验对动物年龄有特定要求(猴类通常需要经过三年的生长之后才能用于实验),加上其漫长的育种周期和低产出率,目前的猴源供应未能跟上急速扩大的市场需求。猴源短缺使实验猴的单价也从2017年的1.4万元一路飙升至2022年的15万元人民币。此外近年几乎所有的商业航空公司都拒绝运送此类动物,国外市场更可谓是“一猴难求”。由于目前没有什么替代品可以减少非人类灵长类动物的使用。因为试验猴在生理和遗传特征上与人类非常相似,除了用于药物安全性评价外,非人类灵长类动物(NHP)在其他许多生命科学领域也都充当了重要的疾病动物模型,这包括了传染病、生殖生物学、再生医学、老年疾病、神经科学以及认知和行为学研究。由于使用NHP进行测试可以满足各国监管机构对药物安全评估的要求,特别在大分子药物的安全性实验中,缺乏实验猴将极大的影响临床药物注册的成功性。一路高涨的实验猴成本和等待时间,也成了制约各国药企新药研发进度的关键,“天价猴哥”一时间成为了影响各国医药工业发展的战略物资。对此,一直依赖从中国进口实验猴的美国药企开始担忧起来了。2018年下半年,美国国家卫生研究院(NIH)组织了两次名为“非人灵长类动物评估与分析”的会议。在会议上,进口猕猴“卡脖子”的问题都是讨论焦点。会上NIH动物中心负责人Alphie Cisar提出,在猕猴的供给方面,需要尽量减少美国对中国试验猴进口的依赖。同时,美国国内各类动物权益保护组织的抗议之声本来就不绝于耳,近两年反对动物试验情绪更是空前高涨,根据皮尤研究中心(Pew Research)2020年的一项民意调查发现,破纪录的有52%的美国人反对动物试验研究。今年,美国通胀率陡增,达到40年来的新高,普通美国家庭生活成本危机加剧,在这个时候,推出这一有可能降低药物研发成本的法案势必能获得广泛支持。据Globe Newswire报道,此次现代化法案获得了包括动物健康行动(Animal Wellness Action),人道经济中心(Center for Humane Economy)等近200个组织,医学协会,生物技术和患者倡导团体的拥护。1970-2022年间美国通胀率同比变化(来源:美国劳动统计局)
但是我们应该看到,动物试验仍然是不可缺少的药物安全性评价手段之一。这次FDA虽然只是放松了对于临床前动物试验的强制性要求,但在美国工业界、动物保护组织、政府和民众看来都是一个多赢的选项。放宽监管边界有助于企业启用新技术,通过应用替代技术优化实验设计和提高质量,从而一定程度上减少不必要的动物试验,有助于企业缓解资源紧缺带来的成本压力和时间损耗。本次FDA法案的发起人之一,新泽西州参议员Cory Booker曾表示:“由于现代科学创新,将动物毒理测试用于实验药物安全性评价已经变得越来越过时。当科学上可靠的替代测试方法可用时,这项立法将消除无数动物的不必要痛苦。”确实,这次新法案的通过,除了有部分政治和经济因素,有效替代动物试验的技术也是必不可少的条件。随着现代生物科学和信息技术的发展,为动物试验的替代方法提供了理论基础和技术支持,体现在充分利用先进技术的精华并加以整合,如分子生物学、组学技术(基因组、蛋白组、代谢组、细胞组)、组织工程技术、干细胞技术、图像分析、高通量试验、计算机模拟技术等,替代方法更复杂化、多元化,也更有逻辑性和更接近人作为整体的实际情况。由于各类动物和人类数据可用性的提高,为人工智能的同步发展奠定了优化数据的基础。云计算是促进“大数据”可视化和分析的资源的一个很好的例子,因为一个用户不需要下载和存储大量数据。各类数据的存储、管理、挖掘和可视化技术的发展至关重要,因为需要对不断产生的数据进行分类和重新排列,以保持数据使用的便捷性。这与药物发现和化学安全性测试相互关联,因为越来越多的可用数据需要“符合目的”的安全性和有效性评估工具,这将大大提高了提交给监管部门所需数据的数量和质量。多种新技术出现也催化了研发思维的突破性转变,出现了“有害结局路径”(AOP)为代表的新型毒理研究范式,从传统的毒理学测试转变到更机器化和数据驱动的范式,最终建立疾病“地图”和计算机方法(In silico),以及体外测试方法(In Vitro),并产生用于填补空白的 AI 衍生数据。最终目标通过更多机器和人类相关数据来阐明生物学途径,从而提高理解能力。英国的AI制药企业Exscientia在2014年就开始进行数据积累,最终收集了1万多种化学物质。然后利用AI系统对数据库中的化学物质进行了86万次的测试,其绘制的分子结构与特定毒性类型之间的关系,很多之前并不为人知,比如可能对眼睛、皮肤或DNA造成的影响。研究人员还对不同化学性质和毒理性质的物质进行分组,然后以组内某一物质的毒性为参照,推测其他物质的毒性。再与这些其他物质在数据库中的已知毒性进行比照,得出计算机预测的结果。最终结果显示,利用计算机测试得到的毒性准确率为87%,而使用动物再次进行测试的正确率仅为81%。这个结果从某种程度上揭示用计算机替代动物试验的潜在可能性。此外,类器官芯片的发展也为动物模型不足和动物模型不能准确预测人体反应提供了解决方案。类器官芯片因为是直接利用人类组织构建,且可定制化为疾病建模;因此可以在临床试验前更充分的进行效价评估,将不合适的药物排除,从而提升药物研发成功率,降低后期药物开发成本且减少动物伤害。此外,类器官芯片和AI技术的融合也将使非动物性体内药物筛选更高效和精准。虽然人工智能和类器官等新技术的应用将带来了全新的研发思路,但目前仍有很多不定因素和未知困难。首先是数据整理问题,用于安全性测试的数据需要长达数年的累积,然后是数据的清洗和整理。其次,动物试验本身也有计算机推测难以比拟的优势。临床前药理/毒理实验中,我们之所以会选用在生理特征上与人类相似的动物来进行,是因为人体组成非常复杂,许多的副作用、机体反应、过敏,往往是在实验室中无法预测的,而使用动物则更容易让我们预测试验药品在人类体内的各种反应。类器官存在异质性问题,比如干细胞可能取自不同的个体,培养出来的类器官在大小、形状和细胞成分方面都是异质的(某些特征存在差异);不仅如此,尽管某些干细胞取自同一个个体、培养在同一个实验室,都会出现这种异质性。虽然已经出现了一系列潜在的动物试验替代技术,但我们应该看到,目前我们所拥有的这些替代技术还不足以让人类放弃各种动物试验。为此,我们采访了深圳埃格林医药的杜涛博士。杜博士是FDA的前审评官员,也是一位在临床前研究和早期临床试验方面很有造诣的科学家。杜博士指出,新出台的《FDA现代化法案2.0》更像一个催化剂,鼓励药企在新药研发中尽可能地限制动物试验,但目前大幅度的削减动物试验仍然是不现实的。“即使美国参众两院都通过了上述法案,FDA仍需要至少1-2年的时间去出台一系列包含各种执行细节的指导文件,而世界各国也不会立刻就会跟着FDA去限制实验动物的使用。”杜涛博士回应道。我们应该看到,无论从伦理上、技术上和成本上,我们必须在减少实验动物的使用。这对全球医药工业即是技术上的挑战,也是新的商机。减少动物使用虽然是未来必须要做到的,但目前我们仍需按照现有法规去开展的临床前药理/毒理实验。“我相信,随着AI技术的不断成熟和替代技术的不断完善,未来将会出现很多可靠的无动物药理/毒理检测方法”。杜涛博士补充说。